—— ||| 背景介绍 ||| ——
通过量身定制的支架控制真核细胞是一个有趣的目标,因为它是一种“编程”或指导细胞行为而不需要遗传修饰的新兴方法。在生物体中,细胞行为受到来自其微环境的不同线索的作用的严重影响,这些线索在三个维度上协同作用。这些微环境线索包括生化因子如可溶性生长因子,细胞-细胞相互作用和细胞-基质结合。此外,生物物理因素如周围细胞外基质(ECM)的机械特性可显着影响细胞反应。同样地,ECM的组成或机械性质的改变通常与病理状况以及癌症进展和转移相关。关于干细胞,包括胚胎干细胞或诱导的多能干细胞,特异性和常3D培养条件是必要的,以一直保持它们的多能性状态,或它们分化成所需的细胞类型。
—— ||| 创新与结论 ||| ——
模拟细胞外基质的性质对于开发活细胞的生理微环境的体外模型是至关重要的。在其他技术中,3D直接激光写入(DLW)已经成为用于实现用于细胞生物学研究的定制3D支架的有前途的技术。这里,回顾了基于DLW解决基本生物学问题的结果,例如细胞力测量和功能化结构上的选择性3D细胞扩散。DLW材料工程和支架制造的创新方法的未来持续进展将使DLW在应用生物医学研究和组织工程中得到进一步应用。
—— ||| 图文一览||| ——
图一

A)DLW技术的示意图。
B)用于细胞生物学应用的选定DLW结构的扫描电子显微照片,范围从简单的碗状结构,用于单细胞培养的支架阵列,用于研究细胞侵入的多孔笼状结构,以及用于细胞的多孔表面上的网格在趋化梯度的影响下的迁移研究。
小结:DLW是一种基于双光子吸收的光刻技术。简而言之,由于下面的工艺的非线性,聚合光刻胶的光子密度在物镜的焦平面上仅足够高。因此,与传统的单光子技术相比,体素另外被限制在轴向方向上。通过激光聚焦于样品的相对运动的x,y,Z -方向,也能够写在微米范围内(任意3D支架图 1A)。关于DLW的化学方面,我们参考了我们小组最近发表的一篇评论。该技术的灵活性允许制造细胞培养支架,范围从简单的柱结构到更复杂的形状。实例包括碗状生长基质,盒状环状结构阵列,具有可调孔隙率的笼子,以及整合在多孔膜上的网格结构(图1B)。
图二 通过DLW获得的用于单细胞研究的支架的技术进展概述
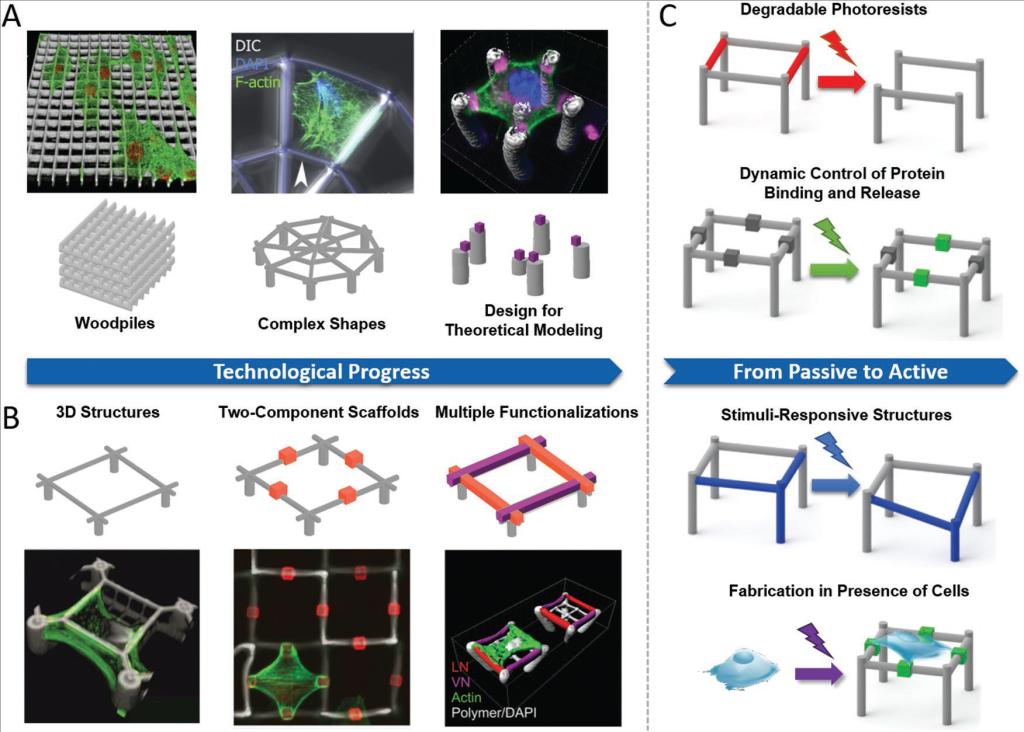
A)3D支架,从基本几何形状(例如,木桩)到复杂形状,再到复杂设计,允许将实验结果与理论建模相结合。左图像经过许可后适应。
B)生物功能化的演变,范围从均匀涂覆的支架,到具有不同粘附位点和多个空间限定的官能化的结构。
C)目前的研究涉及具有可调性质的活性系统,并且涉及在活细胞存在下的制造。
小结:已经证明DLW产生的3D支架可以成功地指导不同细胞类型在增殖和迁移方面的行为。进行对单元中的第一研究,由单一材料(相当简洁3D支架图 2的A)。Hohmann和von Freymann研究了不同3D地形图上成骨细胞样细胞的增殖,发现方形网格中的3D培养相对于六边形结构或非结构化生长基质增强了170%的增殖。这表明3D粘附几何形状可以影响细胞周期进展。为了解决更复杂的生物学问题,与自定义(生物)需要有官能化复杂的3D支架(图2 B)。因此,我们首先开发了具有蛋白质排斥和蛋白质结合材料特性的双组分支架。提出用于细胞粘附的空间定义的生物功能化斑点,我们获得了对3D细胞形状的精确控制。直到最近,我们才引入了基于三种不同组分的几种蛋白质支架功能化的概念。初始支架由驱虫光刻胶构成。随后,添加允许蛋白质吸附的第二种材料。在DLW第三步骤中,应用具有允许与特定蛋白质标签偶联的功能部分的通常排斥的光致抗蚀剂。这些用不同蛋白质功能化的支架用于研究不同细胞类型在其蛋白质亲和力方面的粘附。
图三 支架研究单细胞的力学生物学
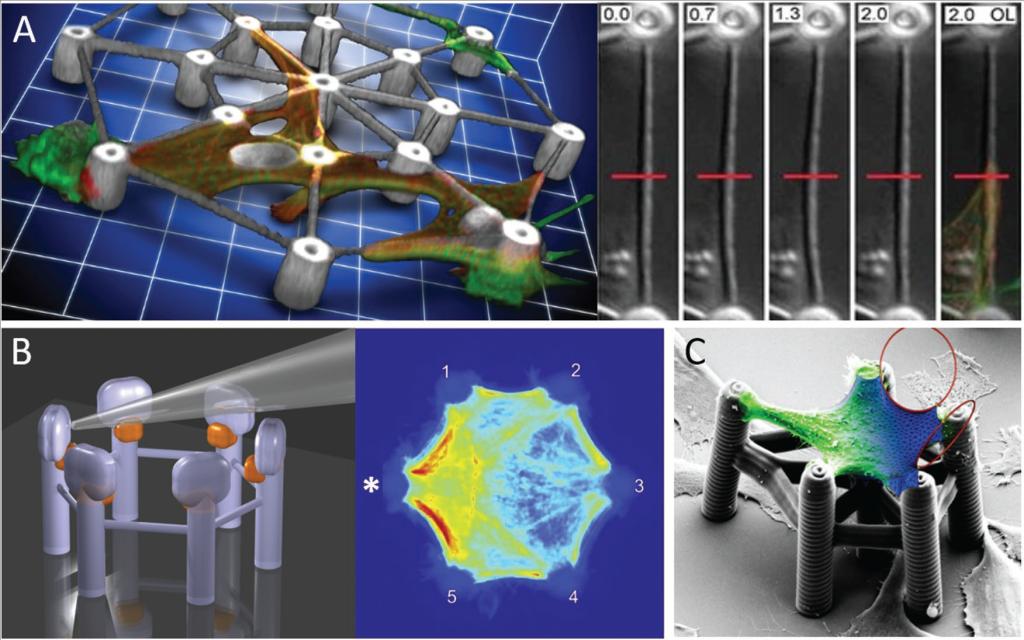
A)具有薄弹性梁的轮状结构允许测量由搏动的心肌细胞施加的力。
B)六角形结构,在一个空间限定的粘附位点(星号)机械刺激单个成纤维细胞。热图表明在操作点处肌动蛋白丝束的强化。
C)用于实验数据与3D细胞形状的理论建模的组合的支架的SEM显微照片。
小结:在此之前,有可能生产具有不同刚度的空间限定区域的3D DLW支架。尽管在培养期间刚度不能变化,但是定制的3D支架允许研究复杂的细胞过程,如力的产生和机械转导。在第一种方法中,我们用可变形梁在支架中培养鸡胚胎心肌细胞(图 3A)。在自发收缩周期期间,这些心肌细胞能够使光束偏转。用原子力显微镜测量梁的弹簧常数使我们能够将偏转程度与心肌细胞产生的牵引力相关联。此外,可以应用3D支架以向单个细胞的特定粘附位点施加力。我们分析了机械应力对弹性,六边形3D支架(图中培养原代成纤维的影响3 B)。通过弯曲单个柱子周期性地或静态地拉伸细胞。由于六边形支架能够精确控制细胞大小和形状,因此它们允许在相同条件下进行多次实验,从而对来自单个细胞的结果进行平均。由此产生的热图解释了细胞 - 基质粘附的微妙但持久的重塑以及肌动蛋白细胞骨架的重排,这是通过分析单个细胞不会强调的。与Schwarz小组合作,我们使用具有空间定义的粘附位点的支架来控制细胞形状和3D生长(图3C)。高分辨率3D细胞重建与数学建模的结合表明,不仅肌动蛋白收缩性而且弹性应力决定了成纤维细胞的形状。通过这项工作,我们追求的模型描述了在2D图案化表面上粘附时的细胞力学。
—— ||| 点评||| ——
在过去的十年中,DLW发展成为一种强大的技术,可以产生明确的,可控的细胞培养生长基质,以指导细胞行为并回答基本的生物学问题。尽管到目前为止大多数实验已经用常用的细胞系进行,但3D支架也具有对神经元和干细胞的受控培养的高潜力。这个方向的第一步已经由Vieu和Malaquin小组进行,这证明了3D支架对神经母细胞瘤细胞的生物相容性。关于干细胞,莱蒙迪和同事提高了制造合成三维利基结构的用于培养各种类型的干细胞,包括间充质干细胞。沿着这条线,Worthington等证明了DLW研究和控制人诱导多能干细胞命运作为底物相互作用的潜力。
对于未来改进的重要步骤是从被动支架到可按需调谐有源系统(图2 C)。再生医学组织工程的一个里程碑将是3D支架的开发,其在植入后缓慢降解而不释放有毒产品。在这种情况下,DLW制造了来自壳聚糖和BSA 等蛋白质的结构。另一种有希望的方法是基于明胶的支架的酶促降解,如Ovsianikov等人的研究所证明的。在存在细胞的情况下。沿着这条路线,Baudis等人。报告生物相容性光弹性体的发展,允许体外降解。然而,对于明确定义的实验条件,还期望制造可通过外部生物相容性刺激(例如,用可见光照射)按需降解的结构。
为了制造由不同细胞类型组成的分层结构,在细胞存在下制造结构将是有利的。为了实现这一点,水溶性和无毒光引发剂是必不可少的。Ovsianikov及其同事在细胞存在的情况下制造了明胶基水凝胶,从而开展了这方面的开拓性工作。最近,秦等人。通过改变DLW水凝胶的细胞指导特性证明了细胞侵袭的时空控制。
为了精确控制3D支架中的组织形成,有必要理解潜在的生物学原理,如微环境中的机械信号。因此,需要动态控制细胞粘附和亚细胞分辨率的分离。这可以通过支架实现,其中蛋白质粘附和释放可以通过外部刺激在微米尺度上触发。最后,改变其刚度或形状的刺激响应支架将允许研究在限定的3D环境中生长的单细胞对局部机械信号的响应。在这方面,我们小组最近的工作表明,3D水凝胶微结构可以通过温度和光控制。
DLW技术,生物功能化材料和技术的进一步发展以及对基本生物学机制的更深入理解将为合理设计的组织工程支架铺平道路。
文献链接:3D Scaffolds to Study Basic Cell Biology. ADVANCED MATERIALS. Marc Hippler, Enrico Domenico, Lemma Sarah, Bertels Eva, Blasco Christopher, Barner‐Kowollik, Martin Wegener, Martin Bastmeyer
https://doi.org/10.1002/adma.201808110
作者简介: 黄轶,华中科技大学,博士
