神经突利用激光直写的微型支架来导向定制神经网络
——||| 前言 |||——
2019年3月,德国汉堡大学,混合纳米结构中心(CHyN)的Cornelius Fendler等人在Adv. Biosys上发表了该文:Microscaffolds by Direct Laser Writing for Neurite Guidance Leading to Tailor-Made Neuronal Networks。
——||| 背景介绍 |||——
在2D基底上,神经突形成和路径发现(神经元极化)的机制在过去已被广泛分析。经典2D神经元体外培养的显着缺点是它们不能充分模拟神经系统中不同的3D连接。大多数标准光刻技术仅适用于2D或2.5D,然而,微纳米制造的最新进展,特别是双光子聚合直接激光写入(2PP-DLW),现在能够构建复杂的基于抗蚀剂的3D基板,其特征尺寸低至≈150nm。使用2PP-DLW,几乎任何机械稳定的结构都可以在几个小时内实现为由生物相容性聚合物组成的真正的3D培养基质。作为2PP-DLW应用于神经突向导的第一步,2014年,Turunen等人使用DLW在平面玻璃基板上印刷墙壁以形成空腔和通道,并在神经网络内部应用具有显微注射系统的层粘连蛋白。虽然设计缺乏有效的细胞约束性能,但被展示出的印刷信道作为轴突导向的潜在功能。
——||| 方法与结论 |||——
本文科研人员提出了一种引导神经元网络生长的方法,其特征在于通过3D支架中的矩形管特别生长的单个神经突。在此展示的设计结合了可调性和3D设计的精度,利用2PP-DLW制造,拓扑和化学预定义的粘合区域以及受控轴突和树枝状生长的引导路径。支架由具有不同高度的支柱组成,通过独立管彼此连接。将小鼠小脑颗粒细胞培养在柱顶部的空腔中。引入的支架设计为未来复杂的神经元网络研究提供了一个有前景的概念,定义的神经元电路具有超越2D的定制设计特定神经突连接。
——||| 图文一览 |||——
图1:CAD图形的结构设计。

(a)该结构由10X10个支柱组成,这些支柱通过独立管连接;
(b)特写结构的一部分,柱子通过内径为2um的独立管与周围的柱子连接。
小结:作为神经元胞体柱的塔顶部具有约20un的横截面,由2.5um厚的壁包围。该设计的构造类似于髓鞘片的构造,在管内具有交替的强约束,并且在腔中的限制较少。Froeter等人已经展示了小于4.4um微管的强烈引导效应,轴突延伸速度在初级皮层神经元的管内强烈加速。相应地选择塔之间的距离,导致管长度≈30μm。选择20μm的腔横截面使得空间足够大以使神经元粘附在底部并通过扩散获得新鲜的培养基,同时也足够窄,因此没有大的细胞簇但只有少数神经元适合一个腔。选择10μm的腔壁高度,使得底部的神经突最可能留在腔内,而底部的细胞胞体可以进行膜片钳测量。选择2μm显影后的最小最终管尺寸,因为入口需要具有一定宽度以使生长锥进入管。同时,这种直径为管内的神经突提供了强大的同轴限制。
图2:在立方体中的水平管上的强度测试结果的示意图和光学显微镜图像。

(a)CAD图形,箭头指向10μm(蓝色),5μm(绿色),3μm(黄色)和1μm(红色)直径的管;
(b)与最佳强度的微小变化导致5和3μm管的部分堵塞(黑色箭头),1μm的管完全堵塞;
(c)在最佳激光强度下,即使1μm的管子也具有干净的形状并且没有堵塞;
(d)在过高的强度下,聚合物被部分破坏,并且一些管被堵塞(黑色箭头)
小结:在印刷支架结构之前,进行强度和优化测试,得到最佳的写入条件。研究了具有圆形和二次截面的管。对于最终设计,选择矩形管。一方面,与圆形管相比,它们在光学显微镜分析中的折射效果方面具有优势。这一事实对于管中神经突的共聚焦分析的潜力是重要的。另一方面,选择矩形形状是因为角和沟槽已经被证明可以作为神经突向外生长的拓扑线索。
图3:用于细胞生长研究的结构的扫描电子显微镜图像。通过用镓聚焦离子束研磨获得管的横截面。

(a)写在盒子里面的结构。小插图:弹簧,将盒子与载玻片连接;
(b)柱结构的放大图像;
(c)中等高度的支柱。左侧和后侧的管道通向较高的支柱,而右侧和前侧的管道向下;
(d)连接管道的横截面。
(e)连接管道的侧视图
(f)连接管的局部图,在聚合物顶部可以看到两层涂层材料(Au和Al2O3),而在管内只能分辨出一层Al2 O3。
小结:在显影之后,观察到与原始CAD设计相比在水平方向上收缩7%,≈50μm。直接写在基础载体的固体表面上,这种效果导致聚合物内的强烈张力和结构与载体玻璃的部分分离。为了补偿张力并增强柱结构的稳定性,预先用IP-Dip写入600×600μm的基盒,使柱子连接到地面,在相同的速率和相同的量下精确收缩。为了防止盒子本身从玻璃载体上脱落,预先在玻璃表面上写入柔性螺旋弹簧。最终结构(也是IP-Dip)通过原子层沉积(ALD)涂覆氧化铝(Al 2O3)作为生物相容性钝化层。在管的铣削天花板上的特写显示在结构顶部的两层不同材料并且在管内仅显示一层。顶层是金,在成像之前沉积以提高分辨率。金下面和管内部的层是Al2O3,证明在光刻支架制备后ALD成功和保形涂覆。
图4:细胞粘附和神经突起引导。

(a)培养支架的共聚焦显微镜图像,其中PDL涂覆在整个支架上。紫色箭头指向管内的神经突。绿松石箭头指向在管外生长的神经突;
(b)PDL涂覆过程中基板的光学图像(顶视图)。移液器在图像中略微着色以获得更高的可见度。上图:玻璃移液管充满PDL溶液,小心地放置在其中一个腔内。下图:移液器接触腔壁的一角。腔体和管充满PDL溶液;
(c)在使用玻璃移液管(10DIV)培养之前,将具有PDL的培养支架直接涂覆到腔和管中。与(a)相比,管内神经突的比例显着改善。强度差异是由略微不同的成像设置和使用不同的探测器引起的。虽然(a)由两个HyD探测器探测到,但在(c)中,用增益设定为≈900的PMT探测器探测到494-540nm的范围
小结:作为第一步,分别使用聚-d-赖氨酸(PDL)和层粘连蛋白来测试整个样品的涂层。一些神经元偶然地沉入腔内,更多数量的细胞以随机分布的方式附着在柱子的外壁上,神经突向外生长部分地发生在结构内部但也发生在结构顶部。注意,腔底部神经突的比例仅通过管延伸,在此阶段已经表明支架设计的拓扑神经元引导特性。为了解决随机神经突向外生长的问题并促进选择性细胞粘附,使用直立的膜片钳设置将PDL直接涂覆到腔体中。
图5:支架内神经元的共聚焦显微镜图像(10 DIV)

小结:仅通过管子传播的神经突在支架设计给出的边界内构建网络。尽管IP-Dip聚合物具有强烈的内在自发荧光,但为了使单个神经突可视化,仅使用一个波长(552nm)进行激发。
图6:在3DIV后穿过两个管的结构内部的轴突的假彩色SEM图像。通过FIB研磨获得横截面。

(a)具有(b-e)内部的神经元的腔和管的图像;
(b)腔内的细胞体细胞和轴突,轴突进入管;
(c)轴突变为管的另一侧并在离开管之前粘在该侧的角上;
(d)轴突穿过一个腔并进入另一侧的管;
(e)轴突穿过第二管。它贯穿整个长度的一个部分图
(f)轴突离开第二个管,以其生长锥结束。
小结:通过聚焦离子束(FIB)铣削制成横截面的高分辨率SEM图像揭示了神经突实际上粘到角落,这证实了角的函数作为用于神经突长出拓扑指南。
图7:细胞活力测试。
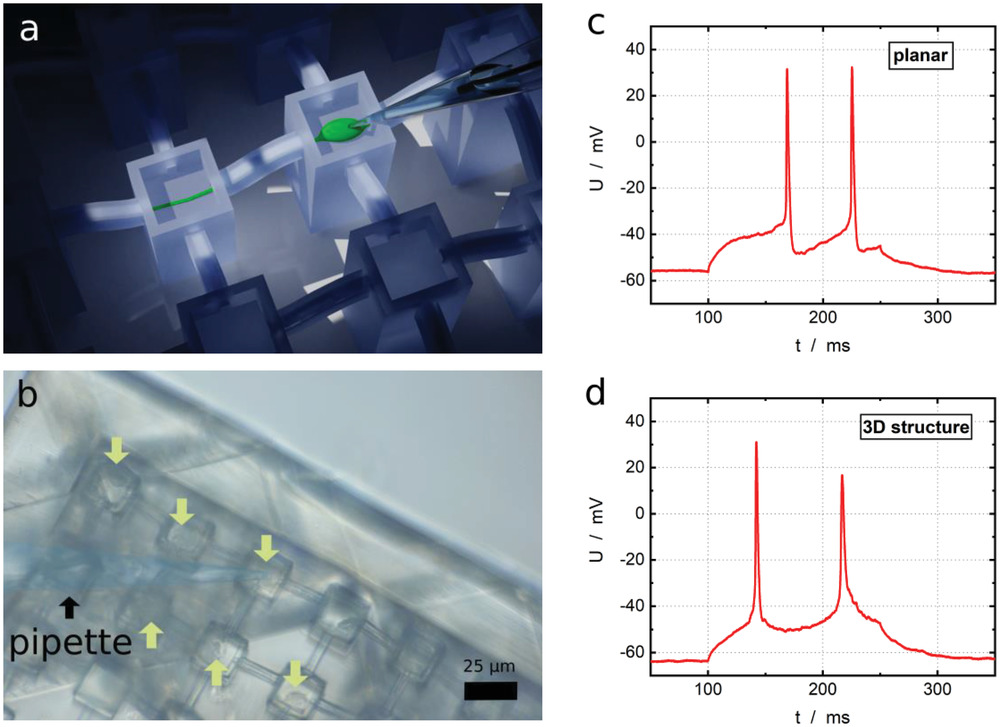
(a)结构中修补神经元的图形。贴片移液管与基底成45°角。一个电极位于贴片移液管内,返回电极位于培养皿中的结构外部。将距离为4mm的物镜从顶部浸入溶液中。
(b)膜片钳测量期间结构内的神经元(10DIV)的光学图像。箭头指向腔内的单个细胞。
(c-d)10 DIV后的电生理学测量结果。在100ms后注射刺激电流150ms。在(c)中,绘制平面培养皿中神经元的单细胞记录,而(d)显示在结构的腔内记录单个细胞。
小结:在10DIV后,在支架内的单个细胞上进行测量,所包含的细胞显示出与生命神经元相似的特征动作电位,与它们生长的底物无关。
——||| 点评 |||——
在这项研究中,发现2PP-DLW可以用于合成3D神经网络,作为神经病学指导来构建神经元网络。因此,设计并成功制造了一种新型结构,该结构具有用于神经突引导到腔之间不同高度的独立管。这些管可以设计成不仅可以在平面上引导,而且可以在任何方向上实现真正的3D,这是迄今为止任何其他方法都无法实现的。通过化学引导的位点特异性粘附与支架中潜在的神经突生长途径的拓扑限制相结合,为体外神经元电路设计开辟了全新的可能性。
Fendler, C., Denker, C., Harberts, J., Bayat, P., Zierold, R., Loers, G., Münzenberg, M., Blick, R. H., Adv. Biosys. 2019, 3, 1800329. https://doi.org/10.1002/adbi.201800329
翻译作者:秦燕亮
